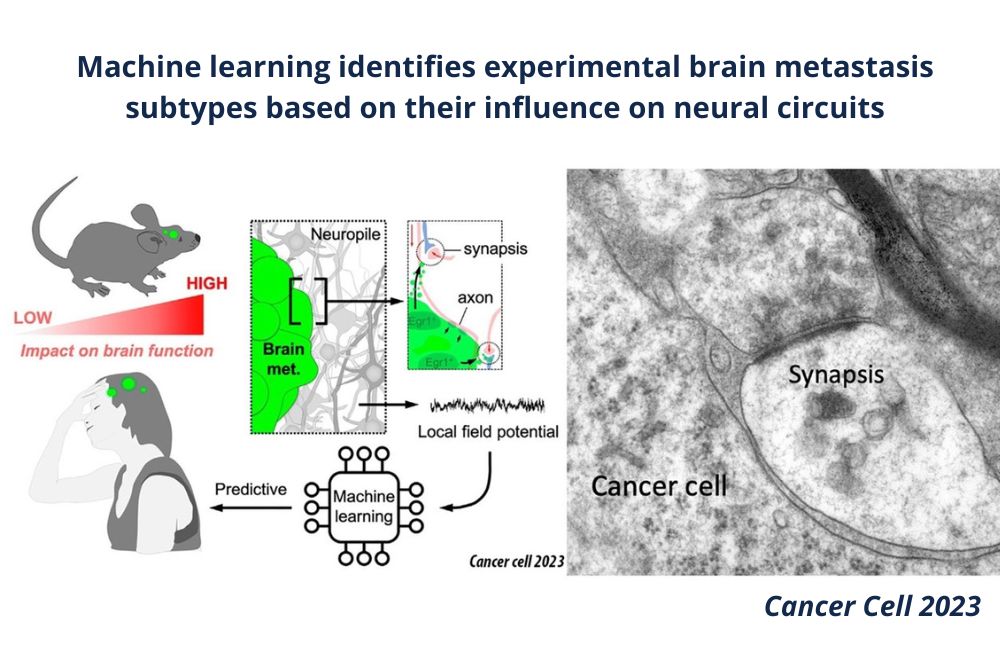
El Dr. Miguel Ángel Lafarga participa en un estudio internacional que aporta avances en las metástasis cerebrales y arroja luz a la búsqueda de nuevas estrategias terapéuticas
Miguel Ángel Lafarga, investigador del Grupo de Biología Celular del Núcleo de IDIVAL y Profesor Emérito de la Universidad de Cantabria (Departamento de Anatomía y Biología Celular) ha participado en una investigación internacional que demuestra que diferentes subtipos de metástasis cerebrales -originadas por células tumorales de carcinomas de pulmón, mama o melanoma- afectan de manera específica a la actividad bioeléctrica cerebral, interfiriendo con la actividad de los circuitos neuronales, mediada por la transmisión de impulsos nerviosos en las sinapsis. Los resultados del estudio “Machine learning identifies experimental brain metástasis subtypes base don their influence on neuronal circuits” han sido publicados recientemente en la prestigiosa revista científica Cancer Cell.
“La metástasis provocada por el cáncer altera la química cerebral e interfiere en la comunicación neuronal, provocando un deterioro cognitivo en los pacientes”.
La investigación ha sido co-liderada por el Dr. Manuel Valiente del Centro Nacional de Investigaciones Oncológicas (CNIO) y la Dra. Liset Menéndez de la Prida del Instituto Cajal (CSIC). El trabajo se enmarca en el proyecto europeo ‘NanoBright’, orientado al estudio de nuevas tecnologías para el conocimiento del cerebro, y con participación de agencias financiadoras como MICINN, AECC, ERC, NIH y EMBO.
Un estudio experimental en ratones con metástasis cerebral
Según explica el Prof. Lafarga, se trata de un estudio multidisciplinar -combina técnicas de neurociencia e investigación oncológica y computacional- realizado en un modelo experimental de ratones con metástasis cerebral.
El análisis con microscopía electrónica demuestra que las prolongaciones neuronales con las sinapsis -los sitios de comunicación neuronal, como descubrió Cajal- están en íntimo contacto con las metástasis, permitiendo una influencia directa de las células tumorales sobre los circuitos neuronales. El estudio electrofisiológico con microelectrodos que registran potenciales de campo, revela alteraciones en la actividad bioeléctrica con una “firma” específica de cada subtipo de metástasis cerebral e independiente del “efecto masa” del tumor por la presión sobre el tejido nervioso. El análisis molecular indica la activación de un posible programa molecular responsable de la disfunción de la actividad bioeléctrica subyacente a las metástasis, e identifica el factor de transcripción Egr1, un modulador de la plasticidad sináptica, como un componente esencial en el proceso. Para confirmar la existencia de una “firma electrofisiológica” específica para cada subtipo de metástasis, los autores utilizaron un sistema de inteligencia artificial que fue entrenado con numerosos datos electrofisiológicos y, en efecto, el sistema aprendió a predecir la existencia de subtipos de metástasis.
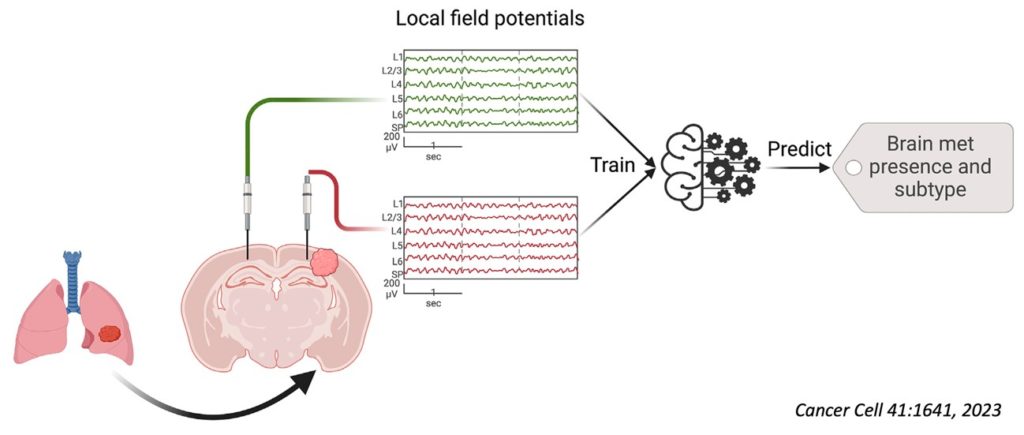
Esta investigación representa un “cambio de paradigma” en el conocimiento de los mecanismos básicos de la metástasis cerebral, particularmente de la compleja interacción entre células tumorales y tejido nervioso, y abre un nuevo horizonte para la prevención, diagnóstico precoz con técnicas no invasivas y búsqueda de nuevas estrategias terapéuticas, particularmente para el diseño de fármacos que palien los efectos cognitivos de las metástasis cerebrales.
Ref. Machine learning identifies experimental brain metastasis subtypes based on their influence on neural circuits. Cancer Cell. 2023 Sep 11;41(9):1637-1649.e11. Alberto Sanchez-Aguilera, Mariam Masmudi-Martín, Andrea Navas-Olive, Patricia Baena, Carolina Hernández-Oliver, Neibla Priego, Lluís Cordón-Barris, Laura Alvaro-Espinosa, Santiago García, Sonia Martínez, Miguel Lafarga; RENACER; Michael Z Lin, Fátima Al-Shahrour, Liset Menendez de la Prida, Manuel Valiente. PMID: 37652007 [DOI: 10.1016/j.ccell.2023.07.010]